Cyprinodontiformes Berg, 1940.

A Ordem dos Cyprinodontiformes foi idealizada e definida pelo ictiólogo russo Lev Semyonovich Berg – 1878-1943 – (mais conhecido, no ocidente, como Leo S. Berg) no ano de 1940, na publicação periódica Trabalhos do Instituto Zoológico da Academia de Ciências da Rússia, Tomo 5, Livro 2 sob o título Classificação dos Peixes ambos Recentes e Fósseis. Berg usou como base para conceber sua ordenação taxonômica a preexistente Ordem dos Microcyprini definida por Charles Tate Regan – 1878-1943 – no ano de 1911 (2).

A partir de sua publicação a nova classificação foi rapidamente aceita pela grande maioria dos integrantes do meio acadêmico, com a exceção de um ou outro ictiólogo mais ortodoxo. Sendo assim, por vezes, ainda hoje encontramos em alguns trabalhos científicos, referências à Ordem Microcyprini com o status de sinônimo de Cyprinodontiformes.
De maneira geral, a classificação idealizada por Berg permaneceu praticamente indisputada por perto de 41 anos, com pequenas alterações, as mais importantes efetuadas por Myers em 1925, e Rosen em 1964 até que a Dra. Lynne R. Parenti – 1954 – ictióloga e sistemata do Museu Nacional de História Natural do Instituto Smithsoniano, nos E.U.A. efetuasse uma audaciosa e profunda revisão (sob a ótica da então emergente sistemática filogenética) como parte de sua tese de doutoramento, no ano de 1981(19).

Em linhas gerais, Parenti excluiu a Subordem Amblyopsoidei composta por apenas uma família, Amblyopsidae cujos membros (troglóbios, ou seja, peixes das cavernas, em sua maioria) apesar de se parecerem externamente com killifishes não tem parentesco direto com estes, tendo, além disso, uma anatomia interna muito similar àquela dos percopsídeos (família Percopsidae) da Ordem Percopsiformes na qual se encontram alocados atualmente.
Paralelamente, no mesmo ano (mas em outro “paper”, em que figurou como coautora) em parceria com o Dr. Donn Eric Rosen -1929-1986 – do Museu Americano de História Natural (AMNH) de Nova York, Parenti excluiria também dos Cyprinodontiformes a Superfamília Adrianichthyoidea (erigida pelo próprio Rosen, em 1962) composta então por três Gêneros distintos que se encontram sinonimizados atualmente no Gênero Oryzias, o famoso medaka ou “killifish” japonês, transferindo-a para a Ordem dos Beloniformes Berg, 1937 (23).

Porém o grande destaque do trabalho da Dra Lynne foi ter elevado os componentes da Subordem Cyprinodontoidei (então subdividida em 6 famílias) ao nível de Ordem, agora subdividida em 9 famílias. Atualmente a Ordem dos Cyprinodontiformes tal como concebida por Parenti destaca-se dentre as demais ordens que integram a classe Actinopterygii por incluir alguns dos mais singulares, exóticos e belos peixes de que se tem notícia.

Tais peixes são capazes de “proezas” de adaptação que beiram as raias do inacreditável, ou seja, seus membros se notabilizam por uma radiação adaptativa a ambientes muito variados, desde os dulcícolas aos salobros, marinhos ou hipersalinos. Ambientes estes, não raramente, caracterizados por parâmetros físico-químicos extremados (temperatura, pH, dureza e baixíssimas taxas de oxigênio dissolvido). Condições tais que, virtualmente, excluem destes biótopos os peixes das demais famílias e Ordens de peixes ósseos.

Composta por peixes de porte pequeno, medindo entre 10 mm (1 cm) e 340 mm (34 cm) de comprimento total (a maioria das espécies não atinge 100 mm (10 cm) encontra-se dividida por nove famílias, grosso modo, separadas pela forma de reprodução (07). Apresentam dimorfismo sexual bem marcado, sendo o indivíduo do sexo masculino, em uma grande percentagem dos Cyprinodontiformes, adornado de coloração conspícua, vistosa e atrativa que os torna altamente desejáveis para a manutenção em aquários (06).

A distribuição zoogeográfica (representada em negro na figura abaixo) é pantropical com a exceção da região Australásica, dos polos e da porção norte de toda a região Holártica (19). Hodiernamente (em nossos tempos) esta distribuição corresponde, com razoável grau de exatidão, às zonas costeiras criadas pelos processos de formação do primevo mar de Tethys e consequente separação dos continentes até chegarem a atual configuração (por volta dos 150 milhões de anos no passado) e se constitui em uma das provas que corroboram a deriva continental preconizada por Wegener (26).
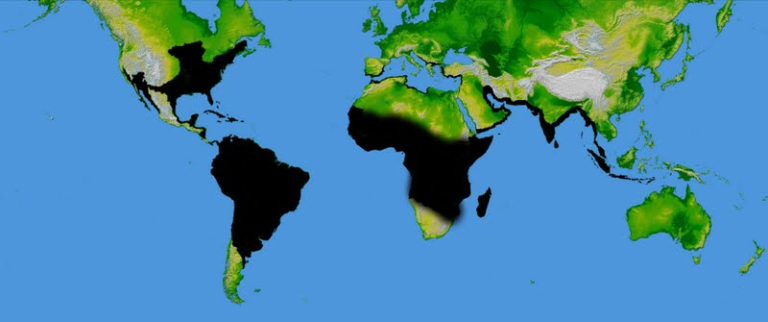

O Mar de Tethys também chamado de Oceano Tethys ou Neo Tethys foi formado no final do período Triássico entre 237 e 201.4 milhões de anos passados e existiu até o início do Eoceno, perto de 50 milhões de anos atrás. Este mar evoluiria de uma simples fenda (rift) até atingir uma enorme extensão de águas, relativamente pouco profundas (quase que um verdadeiro oceano interior), no auge do processo de divisão do primitivo supercontinente PANGAEA ou PANGEA em dois novos blocos continentais, o setentrional Laurásia que, por sua vez, originaria as massas terrestres que atualmente se situam a norte do equador e Gondwana que daria origem aos nossos continentes austrais (15).
Nas lagunas marginais, de baixa salinidade e águas tépidas, formadas ao longo dos litorais deste oceano (teorizam os ictiólogos modernos) localiza-se o ponto de origem de cada espécie ancestral de toda essa extensa e polimórfica ordem (14).

A Ordem está subdividida em duas Subordens, Aplocheiloidei e Cyprinodontoidei ambas definidas por Parenti em seu trabalho de 1981. Está classificação tem nos servido bem desde sua publicação, porém nem tudo são flores nos jardins da filogenia. Nada ali está grafado em pedra! E nem poderia, porque o conhecimento e as ferramentas que empregamos para obtê-lo evoluem constantemente. A bem da verdade existem vozes discordantes sobre o modo como os grupos contidos em Cyprinodontiformes se relacionam. Costa em 2016, por exemplo, reuniu as três famílias da Subordem Aplocheiloidei em uma única família Aplocheilidae. Na visão do estudioso estas famílias passariam a ter o status de Sub famílias. Aplocheilidae se transformaria em Aplocheilinae, Nothobranchiidae em Nothobranchiinae e Rivulidae em Cynolebiinae.
Caso a interpretação proposta por Costa, eventualmente, venha a ser adotada terá o mérito de resolver um problema que perdura desde os princípios da década passada. Acontece que, Rivulidae está sob risco de ser considerado nome inválido por homonimia em virtude de o epiteto (nome) de Subfamília estar ocupado previamente, pois em 1895, Augustus Radcliffe Grote estabeleceu uma Subfamília que ele nomeou Rivulinae (com base no Gênero Rivula) de modo a agrupar alguns Gêneros de determinadas mariposas noctuídeas pertencentes a família Arctidae (atualmente Erebidae). No presente momento são vigentes duas proposições, a primeira das quais (com maior número de adeptos) consistiria em suprimir o homônimo sênior (mais antigo, ou seja, o das mariposas) por ser relativamente pouco usado. Sendo a segunda proposta, justamente, a mudança de Rivulinae para Cynolebiinae cujo nome é de autoria de Hoedeman, 1961. O caso foi submetido para análise da Comissão Internacional de Nomenclatura Zoológica (ICZN) sem prazo definido para sua resolução saiba mais.

Dentre as famílias que compõem a Ordem destacam-se algumas que se caracterizam pela fecundação interna, mediante um órgão intromitente (gonopódio ou andropódio, conforme a família em questão) formado por uma modificação funcional dos raios anteriores da nadadeira anal e também pela produção de crias bem desenvolvidas e aptas para a sobrevivência no ambiente natural (ovoviviparidade).

A família Anablepidae tem uma distribuição exclusivamente Neotropical, abrangendo a vertente costeira atlântica desde o sul do México até o norte da Argentina. Essa família é composta por duas subfamílias, Anablepinae Bonaparte, 1831 e Oxyzygonectinae Parenti, 1981 (19).
Poeciliidae, a família mais numerosa, apresenta uma distribuição muito mais ampla, originalmente restrita às regiões Neotropical, Afro-tropical e uma pequena porção do sul da região Neártica, porém algumas espécies (Poecilia reticulata, Gambusia affinis e G. holbrooki, esta última alcunhada “the fish destroyer”) foram introduzidas a guisa de controle biológico de mosquitos, em praticamente todas as regiões tropicais e subtropicais do planeta, aonde vieram representar, especialmente as duas últimas, sério risco à ictiofauna autóctone (*).

Atualmente está composta por três Subfamílias: Aplocheilichthynae Myers, 1928, Procatopodinae Fowler, 1916, integradas unicamente por peixes de reprodução ovulípara e distribuição Afro-tropical (killifishes) e Poeciliinae Bonaparte, 1831, composta por peixes de reprodução ovovivípara ou vivípara com fecundação interna com a exceção do killifish neotropical Fluviphylax, exclusivamente ovulíparo com fecundação externa (não apresenta gonopódio).

Goodeidae é exclusivamente Neártica e restrita ao centro-norte do México e áreas desérticas e semidesérticas do sudoeste dos E.U.A.. Igualmente apresentam fecundação interna, porém utilizam uma estrutura intromitente diversa (o andropódio) daquela apresentada pelos peciliídeos, formada pela porção anterior da nadadeira anal que se encontra dividida em duas e, ainda, por uma ligação entre o embrião e o corpo da mãe (viviparidade), por meio de uma estrutura denominada trofotenia (25).Essa família está dividida por duas subfamílias Goodeinae Jordan e Gilbert, 1883 e Empetrichthynae Jordan, Evermann e Clark, 1930.

As demais famílias desta Ordem são formadas por gêneros contendo espécies exclusivamente ovulíparas (fecundação externa) e, muito raramente, uma ou outra ovípara (fecundação interna). Os integrantes destas famílias somados aos representantes ovulíparos das famílias apresentadas acima constituem os famosos killifishes.
Aplocheilidae é Paleártica (restrita ao sul do subcontinente Indiano e sul do sudeste da Ásia) e Etiópica (atualmente região Afro-tropical que abrange toda a África subsaariana, ou seja, praticamente todo o continente africano, com a exceção das zonas mais desérticas), ovulíparos por excelência, se destacam pelo colorido e morfologia exuberantes, que é ostentado pelos exemplares de sexo masculino na maioria das espécies (19).

Os Cyprinodontidae estão disseminados pelas regiões Neártica (Caribe, América Central e sul da América do Norte), Neotropical (lagos andinos) e Paleártica (ao longo da zona costeira norte do mar mediterrâneo e oriente médio) na maioria dos casos segregados em coleções de água isoladas, de dimensões reduzidas e submetidas a processos de degradação antrópica (processos causados por atividade humana).


Fundulidae encontrados na região Neártica, ao longo de toda a costa leste dos Estados Unidos e em algumas ilhas do Caribe. Fundulus heteroclitus foi primeiro ciprinodontiforme a ser descrito cientificamente por Linneu em 1766.

Os Profundulidae formam um grupo pequeno (dois gêneros e nove espécies) e sua distribuição se restringe às vertentes do Pacífico e do Atlântico, na Guatemala, Honduras e no México.

Valenciidae acha-se restrita atualmente ao gênero Valencia, contando com apenas três representantes Valencia hispanica, V. letourneuxi e V. robertae, ocorrentes em localidades restritas e isoladas (submetidas às constantes ameaças de drenagem das zonas pantanosas em que vivem devido ao crescimento urbano acelerado) nas zonas costeiras mediterrâneas da Espanha e da Grécia (19).

Rivulidae, segunda família em número de espécies, se distribui pela região Neotropical, com alguns membros ocorrendo na porção sul da zona Neártica (costa Atlântica) e está subdividida em duas subfamílias Rivulinae e Cynolebiatinae (18).

A mais numerosa destas subfamílias, Rivulinae está composta por gêneros habitam coleções de água permanentes, tendo, porém, a capacidade de se deslocar pelos filetes de água que interconectam os corpos hídricos (rios, córregos, etc….) durante o período chuvoso, podendo invadir, temporariamente, as poças de água de chuva (24).

Kryptolebiatinae (também referido como Kryptolebiasinae) clado erigido em 2004 reúne um complexo de espécies cujas relações filogenéticas não se encontram totalmente esclarecidas (08). Essa Subfamília ainda não obteve consenso e muito especialistas preferem incluir o grupo entre os Rivulinae. Contando com 7 espécies consideradas válidas, o expoente máximo deste grupo é representado por um mal resolvido complexo de espécies formado por Kryptolebias marmoratus, K. hermaphroditus, K. ocellatus e, provavelmente, mais umas duas ou três outras que habitam a zona intertidal dos manguezais, apresentando uma série de adaptações ao ambiente que intrigam, fascinam e deixam perplexos os homens de ciências ao redor do globo (11). Espécies monoicas que apresentam o raro fenômeno do androdioicismo constituindo-se nos únicos casos, documentados, de hermafroditismo verdadeiro em organismos vertebrados (16).

A segunda subfamília, Cynolebiatinae desenvolveu, ao longo de extensa história evolutiva, uma série de adaptações que lhes permitem cumprir, integralmente, o ciclo de vida em coleções de água temporárias, um nicho inexplorado pelas demais espécies de peixes neotropicais. Inexoravelmente atrelados aos ciclos pluviométricos regionais, os cinolebiatinos são vulgarmente conhecidos e citados na literatura como “peixes anuais” ou “peixes das nuvens” (06).

Compõem um grupo estimado em mais de uma centena de espécies, distribuídas pela faixa costeira oriental da América Central e a quase totalidade da América do Sul ( excetuados os Andes e sua vertente oriental e a Patagônia) ocupando de maneira exclusiva coleções de água (conhecidas vulgarmente como poças) que existem apenas durante a estação chuvosa e que secam por completo durante a época de estio. Suas gerações se perpetuam graças ao expediente de depositar ou enterrar os ovos em meio a lama do substrato, onde ficam aguardando até o retorno das águas para iniciarem um novo ciclo vital.

Este admirável fenômeno não é exclusivo dos ciprinodontiformes neotropicais sendo encontrado no gênero afro-tropical Nothobranchius (família Nothobranchiidae) em um admirável exemplo de adaptação e convergências evolutivas em paralelo (17).

Os ovos produzidos pelos integrantes deste grupo costumam ter um pequeno diâmetro (entre menos de 1 e 2,5 mm) e são protegidos da dessecação por uma espessa membrana envoltória (ou córion) passando em estado de latência ou diapausa, por todo o período de seca e os pequenos alevinos livre-natantes (a fase larval é completada no interior do ovo) eclodem tão logo se inicie a próxima estação chuvosa. Essa sequência de acontecimentos levou-os a ser conhecidos, em determinadas regiões do nordeste de nosso país, como “peixes das nuvens”, pois a população local não atinou com outra explicação, mais plausível, para o fenômeno (02).
Esta estratégia de sobrevivência se baseia, em nível celular, na dispersão e subsequente reagregação dos blastômeros durante o desenvolvimento embrionário e na ocorrência de uma ou mais diapausas em etapas definidas deste desenvolvimento. Esse tipo de estratégia é exclusivo dos Cyprinodontiformes anuais não sendo compartilhado com nenhum outro grupo conhecido de teleósteos.
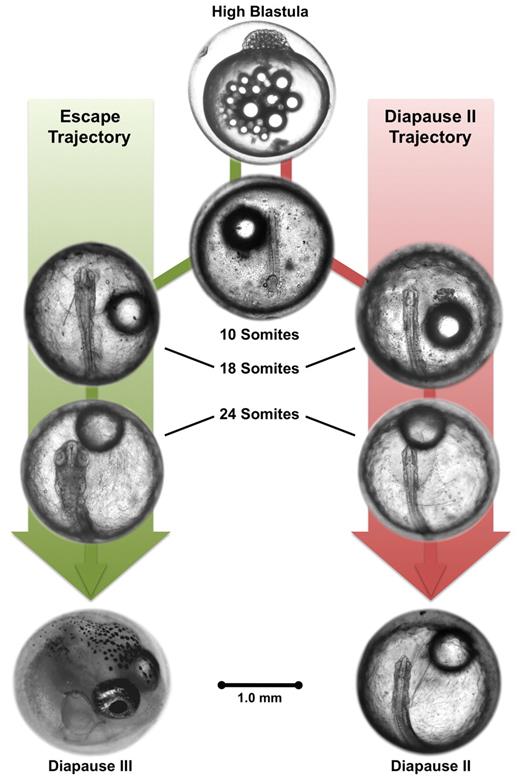
A diapausa consiste na suspensão do desenvolvimento embrionário, geralmente, deflagrada por condições desfavoráveis no ambiente. Os embriões dos peixes anuais podem apresentar de um a três estágios bem definidos de diapausa denominados diapausa I, II e III (13).
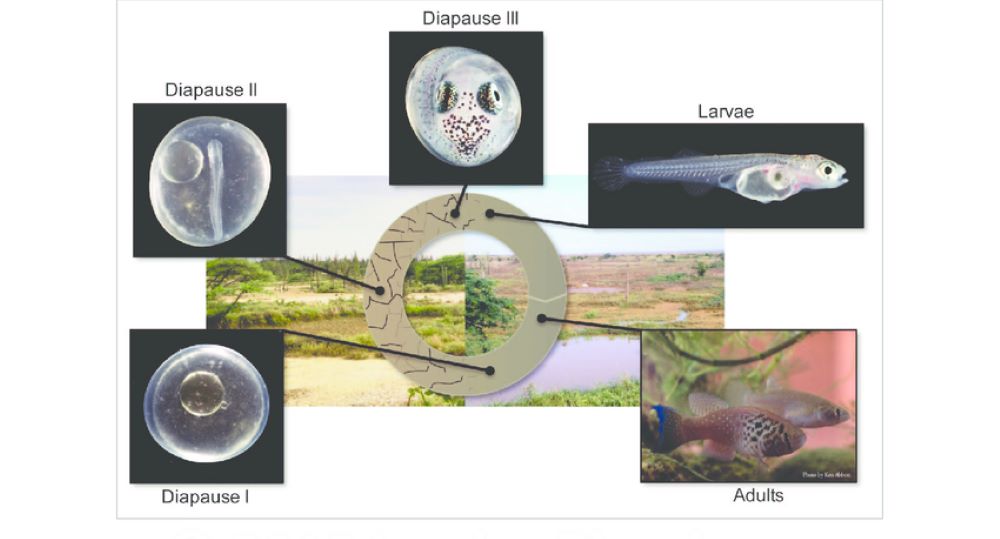
As diapausas podem se prolongar por muito tempo (entre meses e anos). Experimentos realizados com ovos embrionados de um peixe anual venezuelano, Austrofundulus limnaeus demonstraram uma extrema capacidade de resistência à desidratação, por longos períodos de tempo, graças ao espesso envoltório que protege os ovos destes peixes. Secreções acumuladas no espaço perivitelínico destes ovos parecem ter, também, papel importante no fenômeno, funcionando como uma blindagem acessória contra a desidratação, no decurso da fase II da diapausa.
No decorrer destes experimentos demonstrou-se que danos infligidos ao revestimento dos ovos durante o período de estresse hídrico conduzem a uma rápida perda de água e morte dos embriões. (20).

Ademais das extremadas especialização e adaptação as condições dos biótopos, os cinolebiatinos apresentam distribuição pontual (alto endemismo), populações pouco numerosas e/ou altamente flutuantes e limitada capacidade de dispersão, preenchendo todas as condições necessárias para serem considerados vulneráveis (01).

Não bastasse isso, são vítimas colaterais do uso indiscriminado de defensivos químicos utilizados no combate aos vetores de moléstias e às pragas agrícolas (GHISOLFI, 1990; COX, 1993). Uma grande percentagem das espécies de Cyprinodontiformes se encontra diretamente ameaçada pela especulação imobiliária, drenagem das várzeas para obtenção de campos de cultivo, formação de barragens hidrelétricas e por obras de transposição do curso dos rios para projetos de irrigação (04).
REFERÊNCIAS:
01-BARLOW, G. W. THE CICHLID FISHES. Perseus Publishing, Cambridge, p. 260, 2000.
02-BERG, L. S. Classification of Fishes Both Recent and Fossils, J. W. Edwards, Ann Harbour, Michigan, p. 87-517, 1947.
03-CARVALHO, A.L. NOTAS PARA O CONHECIMENTO DA BIOLOGIA DOS PEIXES ANUAIS. Revista Brasileira de Biologia, Rio de Janeiro, v. 17, n. 4, p. 459-466, 1957.
04-CORRÊA, M.S. 2005. Uma família na rota de colisão. Disponível em: Acesso em 22 abr. 2008.
05-COSTA, W.J.E.M. Análise filogenética da família Rivulidae (Cyprinodontiformes, Aplocheiloidei). Revista Brasileira de Biologia, Rio de Janeiro. n. 50, p. 65-82, 1990.
06-COSTA, W.J.E.M. Pearl killifishes: the Cynolebiatinae – A revision of the neotropical subfamily of annual fishes. Neptune City: TFH Publications, p. 128, 1995.
07-COSTA, W.J.E.M. Phylogeny and Classification of the Cyprinodontiformes (Euteleostei: Atherinomorpha): A Reappraisal. In Malabarba, L.R., Reis, R.E., Vari, R.P. Lucena, Z.M. Lucena, C.A.S. Phylogeny and Classification of Neotropical fishes part 6 (Atherinomorpha), Porto Alegre. P. 603, 1998.
08–COSTA, W.J.E.M. Kryptolebias, a substitute name for Cryptolebias Costa, 2004 and Kryptolebiatinae, a substitute name for Cryptolebiatinae Costa, 2004. Neotropical Ichthyology. Porto Alegre, v. 2, n. 2, p.107-108, 2004.
09–COSTA, W.J.E.M.”Comparative morphology and classification of South American cynopoeciline killifishes (Cyprinodontiformes: Aplocheilidae), with notes on family-group names used for aplocheiloids” . Vertebrate Zoology. 66 (2): 125–140, 2016.
10-COX, C. Carbaryl, Part 2. Journal of Pesticide Reform. Northwest Coalition for Alternatives to Pesticides, Eugene, v. 13, n. 2, 1993.
11-DOLGIN, E. The swamp fish that loves to live in trees. New Scientist, Londres, n. 2626, 19 Oct. 2007.
(*) GAMBUSIA CONTROL NETWORK. Base de dados. Disponível em: Acesso em 21 mai. 2009.
12-GHISOLFI, J.C. O KILLIE EM DESTAQUE. Boletim da UPK – UNIÃO PAULISTA DE KILLIFISHES. Set – Out., p. 2-3, 1990.
13-GUTIÉRREZ, V.; AREZO. M.J.; GARCIA, G. Characterization of partial Hox gene sequences in annual fish of the subfamily Cynolebiatinae (Cyprinodontiformes, Rivulidae) Genetics and Molecular Biology, Ribeirão Preto, v.30, n. 2, p. 494-503, 2007.
14-HREBK T.; MEYER, A. Closing of the Tethys Sea and the phylogeny of Eurasian killifishes (Cyprinodontiformes: Cyprinodontidae). Journal of Evolutionary Biology, Exeter, v. 16, n. 2003, p. 17-37, 2002.
15-KAZLEV, M.A., Palæos, Base de dados. Disponível em: Acesso em 7 mar. 2008.
16–MACKIEWICZ, M. et al. Extensive out crossing and androdioecy in a vertebrate species that otherwise reproduces as a self-fertilizing hermaphrodite. Proceedings of the National Academy of the Sciences. Whashington, v. 103, n. 26, p. 9924–9928, 2006.
17–MURPHY, W.J., COLLIER, G.E. A Molecular Phylogeny for Aplocheiloid Fishes (Atherinomorpha, Cyprinodontiformes): The Role of Vicariance and the Origins of Annualism Aplocheiloid Phylogeny, 1997. Disponível em: . Acesso em 24 nov. 2009.7-
18-NIELSEN, D.T.B. Simpsonichthys e Nematolebias. Cabral Editora e Livraria Universitária. P. 3-235, 2008.
19-PARENTI, L.R. A phylogenetic and biogeographical analysis of Cyprinodontiform fishes (Telostei, Atherinimorpha). Bulletin of the American Museum of Natural History. New York, v.168, p. 337-557, 1981.
20-PODRABSKY, J. E.; CARPENTER, J. F.; HAND, S.C. Survival of water stress in annual fish embryos: dehydration avoidance and egg envelope amyloid fibers. American Journal of Physiology – Regulatory, Integrative and Comparative Physiology, Los Angeles, v. 280, p.123-131. 2001.
21-PODRABSKY, J.E.; CULPEPPER, K.M. Cell cycle regulation during developmente and dormancy in embryos of the annual killifish Austrofundulus limnaeus. Cell Cycle 11:9, 1697-1704, 2012.
22-REICHARD M.; POLACIK, M. Nothobranchius furzeri, an ‘instant’fish from an ephemeral habitat. Elife, Disponível em: . Acesso em 12 fev. 2024.
23-ROSEN D. E.; PARENTI, L. R. Relationships of Oryzias and the groups of atherinomorph fishes. American Museum Novitates, 2719: 1-25, 1981.
24-SHIBATTA, O.A.. Reprodução do pirá-brasília, Simpsonichthys boitonei Carvalho (Cyprinodontiformes, Rivulidae), e caracterização de seu habitat na Reserva Ecológica do Instituto Brasileiro de Geografia e Estatística. Brasília. Revista Brasileira de Zoologia, Brasília, v. 22, p. 1146-1151, 2005.
25-TURNER, C.L. Viviparity superimposed upon ovo-viviparity in the Goodeidae, a family of Cyprinodont Teleost fishes of Mexican Plateau. Journal of Morphology, New York, v. 55, n. 2, p. 207–251, 1933.
26-WAGGONER, B. UCMP – University of California, Base de dados. Disponível em: Acesso em 7 mar. 2008.
REFERÊNCIAS das IMAGENS:
